Atomen
Alle materie is opgebouwd uit atomen. Er bestaan een honderdtal verschillende atomen, elk met hun specifieke kenmerken en eigenschappen. Verschillende atomen kunnen op hun buurt gecombineerd worden tot moleculen, die op hun buurt dan weer andere kenmerken en eigenschappen hebben. Atomen zijn zeer klein (ordegrootte \(picometer\) of \(10^{-12}m\)).
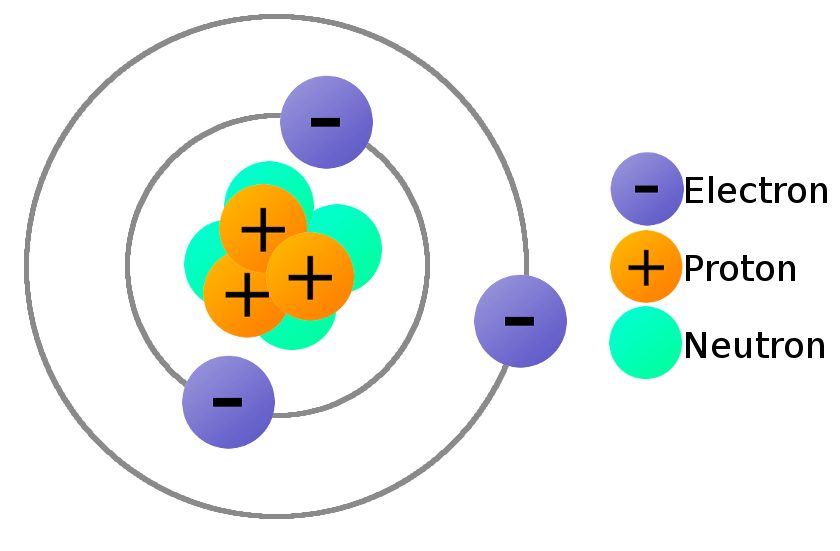
Bouwstenen van atomen
Atomen zijn opgebouwd uit 3 bouwstenen: elektronen, protonen en neutronen. De kern is opgebouwd uit de positief geladen protonen en de neutraal geladen neutronen. Simpel gezegd, zweven de negatief geladen elektronen rond de kern in een elektronenwolk.
De massa van een proton en neutron zijn praktisch gelijk en ~1800x groter dan die van een elektron. De massa van een atoom zit dus geconcentreerd in de kern.
Elk atoom moet minstens 1 atoom bevatten. Waterstof heeft 1 proton, helium heeft er 2, koolstof heeft er 6, koper 29, ...
De elektrische lading van een stof is een eigenschap, net zoals massa en grootte eigenschappen zijn. We kunnen ze meten. De lading van een proton of elektron is 1,6022 × 10-19 C (Coulomb) = elementaire lading.
Ionen
Wanneer een atoom evenveel protonen als elektronen bevat, is het elektrisch neutraal. Wanneer het aantal protonen en elektronen niet hetzelfde is is het atoom niet langer elektrisch neutraal maar heeft het een elektrische lading. Wanneer er meer protonen dan elektronen zijn heeft het atoom een positieve lading. We spreken dan over kationen. Omgekeerd, wanneer er meer elektronen zijn dan protonen heeft het atoom een negatieve lading. We spreken dan over anionen.
Geleiders, niet-geleiders en half-geleiders
De beweging van elektronen is niet willekeurig, maar voldoet aan bepaalde wetten. Elektronen kunnen enkel discrete energiewaarden aannemen. We zeggen dat elektronen in bepaalde energieniveaus of energieschillen zitten. Het maximaal aantal elektronen in een schil is 2n², met n de rangnummer van de schil. De schillen duiden we aan met een letter: K, L, M, N, O, P en Q. In de buitenste schil zitten maximaal 8 elektronen (behalve in de K-schil).
Wanneer er 8 elektronen in de buitenste schil zitten spreken we van een edelgas. Edelgassen gaan (in normale omstandigheden) geen verbindingen aan met andere stoffen. Chemische verbindingen streven naar een edelgas structuur.
Atomen met minder dan 4 elektronen in de buitenste schil staan deze graag af om tot een volle buitenste schil te geraken, atomen met 4 of meer elektronen in de buitenste schil nemen er liever op. De elektronen in de buitenste schil noemen we de valentie elektronen. De buitenste schil noemen we de valentieschil.
In chemische verbindingen zijn meestal geen vrije elektronen beschikbaar. Maar als we energie toevoegen komen, kunnen sommige elektronen los (ze gaan naar een hogere energieband, de geleidingsband) en is er geleiding mogelijk.
Het verschil tussen geleiders, half-geleiders en niet-geleiders wordt bepaald door de afstand tussen de valentieband en de conductieband. Bij geleiders is deze afstand klein of overlappen ze mekaar. Bij de halfgeleiders silicium en germanium zijn deze afstanden respectievelijk 0,7eV en 1.1eV. Bij isolatoren is deze afstand vele malen groter.
De elektronvolt is de eenheid die gebruikt wordt om energieën op atomaire schaal te meten (1eV = 1,6022 x 10-19J, of de energie die een elementaire lading ondervindt in een potentiaalverschil van 1 Volt.
Aan halfgeleiders worden verontreinigingen toegevoegd om de elektrische geleidbaarheid te vergroten. We spreken hier van doperen. We onderscheiden 2 soorten dopering: p-dopering (positieve vrije ladingsdragers) en n-dopering (negatieve vrije ladingsdragers).
De powerpoint uit de les:
Los nu de volgende invuloefening op.